大動脈、末梢動脈については心臓の教科書にまとめられることが多いため、ここで記載する。
大動脈解離
大動脈に関して、造影CTで評価する機会が多いのは解離と動脈瘤である。
突然発症の胸痛を訴える患者の搬送依頼。救急当直中に緊張が走る瞬間である。本物である可能性は決して高くないが、何はともあれ心電図で心筋梗塞を否定してCTで解離の有無を確認する。直近の腎機能データがあればいきなり造影CTができるが、無い場合の方が多く、採血⇨結果待ちの間に単純CT、採血結果が出てから造影CTとするか、臨床所見から本物の可能性が高そうな場合には腎機能結果を待たずに造影CTを行うこともある。
ご存じの通り、弓部大動脈を含むStanford A型か、含まないB型か、大動脈基部まで解離が及び、心タンポナーデなどをきたしているかどうかで治療方針が変わる。単純CTの所見であっても、解離の有無や解離の範囲の評価は、臨床的に極めて重要である。大動脈基部~上行大動脈にかけては心臓の拍動の影響を受けやすく、径を過大評価してしまう可能性がある点に注意する。解離は、構造が疎な中膜で生じるため、内膜の偏位が見られるかどうかで評価する。解離の好発年齢の患者では内膜に大なり小なり石灰化があるため、造影前の単純CTも見たい。また造影相は大動脈の形態をみるための早期相と、解離腔の血行動態(entryが小さく、造影に時間がかかる偽腔開存型もある)をみるための後期相が必要である。症状が胸部のみであっても解離が広範囲に及ぶことがあり、必ず頸部~鼠径部にかけて撮影を行う。大動脈解離=造影CTのイメージがあるが、実は単純CTで約9割の大動脈解離は診断が可能という報告がある(大谷ら. 日救急医会誌. 2013; 24: 149-56)。石灰化した内膜の偏位のほか、偽腔を示す三日月状の淡い高吸収域、flapそのもの、心膜腔内の血腫など、単純CTでも評価可能な所見が挙げられている。造影CTを待つ間、単純CTでも大動脈をじっくり観察し、解離を疑う所見を探すことが重要である。
解離はガイドライン上、偽腔開存型、偽腔閉鎖型、ULP型に分類される。ULP(ulcer-like projection)は偽腔閉鎖型解離でみられる内膜面の潰瘍状・楔状の欠損像であり、画像所見に対する用語である。ULPを伴う偽腔閉鎖型解離は、偽腔開存型への移行のリスクがあることから、ULP型と区分されている。Stanford A型解離のうち、偽腔開存型、ULP型は原則手術が選択される。偽腔閉鎖型では、心タンポナーデや大動脈弁逆流を併発している場合は手術の適応となる。また大動脈径が50mm以上や血腫の厚さが11mmを超える場合も破裂のリスクが高く手術が考慮される。
ULPと似た用語に、PAU(penetrating-atherosclerotic ulcer)というものがある。これは動脈硬化性変化による内膜の不安定プラークに潰瘍が生じた状態を指す病理学的な用語である。進行すると破裂のリスクがあるが、解離への進展は稀とされる。ULPと似た像を呈することもあるが異なる病態であり、混同しないように気を付けたい。さらに、ULPと混同されやすい所見として、IBP(intramural blood pools)がある。これは解離をきたした中膜腔の血腫増大により分岐血管の架橋部分に断裂が生じ、minor leakが生じた状態を指す。ステント留置後のtype2エンドリークがちょっとイメージに近い。血腫内の外側に孤立性に形成される点がULPとの鑑別点となる。15mm以下の小病変の場合、自然に退縮することが多いとされる。このように、ULPを深堀すると混同しやすい用語が複数出てきてしまい、まさにULPから解離腔が広がるように混乱が広がってしまう恐れがあり、慎重な学習が必要である。
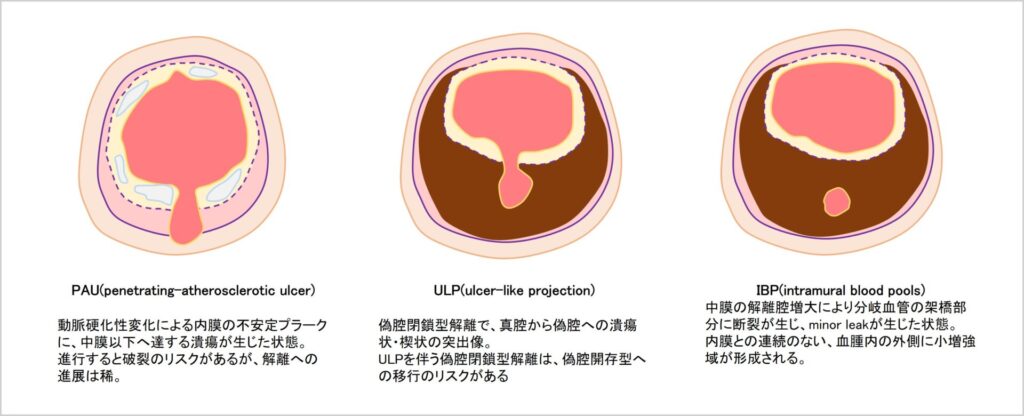
(図3-4-1 PAUとULPとIBP)
ちなみに、解離の分類を確認する過程で、弓部大動脈がどの範囲までなのかが気になり、確認を行った。ネット上や教科書で、大動脈のシェーマは数多く目にするが、弓部がどの範囲までなのか、下行大動脈との境界はどこなのかを明記したものはほとんどない。調べたところ、解剖学的には弓部大動脈は左鎖骨下動脈分岐までと定義されている。一方で、臨床的には腕頭動脈起始部から第3から第4胸椎の高さ( 肺動脈の左右分岐の部位)までという定義が一般的に用いられている(大動脈瘤・大動脈解離診療ガイドライン2011年版)。そして左鎖骨下動脈分岐以遠は『遠位弓部』という用語が用いられる。
大動脈瘤
一般的にみられる大動脈瘤は、動脈硬化性変化により血管壁が脆弱化することで形成される真性瘤である。イメージ的に、動脈硬化の進んだ血管は石灰化でガチガチとなっており一見頑丈そうだが、実は中膜の平滑筋組織は破壊され、菲薄化もしくは消失した状態であり、物理的に脆弱化している。動脈瘤の定義として、局所の嚢状拡張もしくは直径が正常径の1.5倍(胸部で45mm、腹部で30mm)を超えて紡錘状に拡大した状態を指す。 直径が1.5倍以下の場合は『大動脈拡張』と表現する。よく胸部X線や腹部エコーで胸腹部大動脈瘤を疑いCTが撮影されるが、基準を満たさない場合には『大動脈瘤はありません』と一蹴するのではなく、局所的な拡張があれば『大動脈の拡張がみられます』と記載する。
頻度が高いのは腎動脈分岐下の腹部大動脈瘤である。総腸骨動脈分岐部は、腹部大動脈からストレートに来た血流がドカンとぶつかる部位であり、力学的に瘤が形成されやすいことは理解しやすい。約40%で瘤は腸骨動脈に及ぶ。一方で腹部内蔵動脈や腎動脈に瘤が及ぶのは約5%に過ぎない。胸部・腹部とも、最大短径55mm以上の場合や、5mm/半年以上の拡大を示す場合で侵襲的治療が考慮される。Marfan症候群などの遺伝性大動脈疾患や大動脈二尖弁がある場合、最大短径45mm以上で侵襲的治療を考慮する。これらの病態の場合、上行大動脈のみに拡大が見られやすいという特徴がある。
腸骨動脈瘤については、血管径が正常腸骨動脈の1.5倍以上あるいは最大短径25mm以上を瘤と定義する。30mm未満では破裂のリスクは低く、35mm以上で厳重な経過観察もしくは侵襲的治療を考慮する。
感染性動脈瘤vs炎症性動脈瘤
大動脈瘤があるが、なんとなく不整な形態で動脈壁が肥厚している。発熱や炎症反応高値が見られる。そういった時に鑑別に挙げるのが感染性動脈瘤と炎症性動脈瘤だが、感染も結局炎症じゃんということで両者の鑑別は相当な曲者であり、どれがどれだったかあやふやな病態ランキングのおそらくTOP3に入る。
感染性動脈瘤は、感染に起因した瘤形成及び既存の動脈瘤に感染が加わった病態を指す。炎症に伴い壁構造は破壊され、仮性瘤の状態となっている。炎症の進行により急速な瘤拡大や破裂のリスクがある。画像上は限局した嚢状瘤が多く、瘤壁は厚く浮腫状で、周囲組織の濃度上昇や後期相での増強効果が特徴とされる。瘤辺縁部での膿瘍形成を示唆する液貯留は感染性大動脈瘤を示唆する所見である。
一方の炎症性大動脈瘤は、腹部大動脈壁への局所の炎症が関与する動脈瘤で、約半数はIgG4関連で発症する。慢性の大動脈炎・大動脈周囲炎により動脈壁の脆弱化が生じ、瘤を形成する。腎動脈分岐下に好発し、腹部大動脈の5-10%と意外と頻度が高い。画像上の特徴として、内腔・肥厚した内膜もしくは血栓層・遷延性に増強される瘤壁の3層構造(mantle sign)が挙げられる。外膜部分には組織学的に高度の慢性炎症細胞浸潤、線維性肥厚を認め、内膜には粥状硬化症を認めることが多い。
両者の鑑別点として、感染性大動脈瘤は嚢状瘤、急速な増大、瘤辺縁部での膿瘍形成を示唆する液貯留などが挙げられ、炎症性動脈瘤では紡錘状の瘤、比較的穏やかで慢性経過の増大、mantle signなどが挙げられる。しかしながら発熱や炎症反応高値、動脈壁肥厚を伴う瘤形成、動脈周囲への炎症の波及など、共通点が多いのも事実である。感染性大動脈瘤の急性期には壁の肥厚や浮腫がmantleっぽく見えることもあり、正直鑑別が難しい場合もあることも認識しておく。
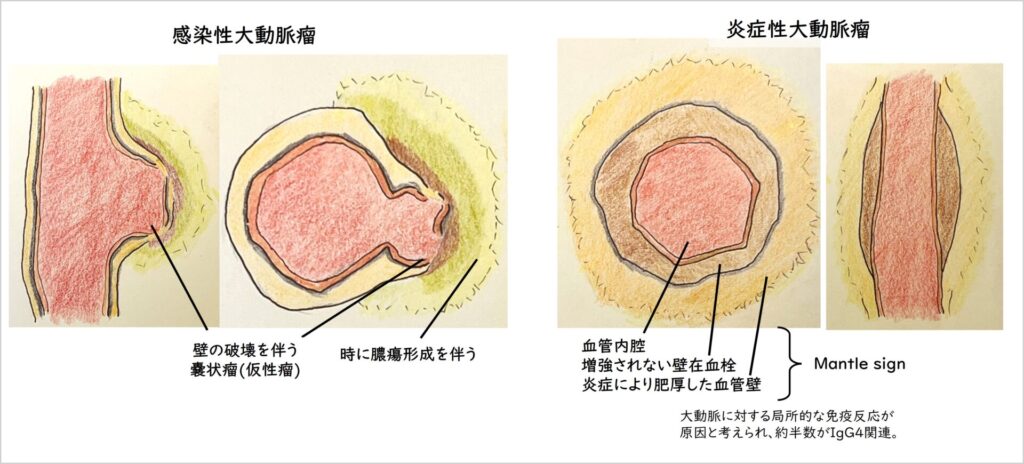
(図3-4-2 感染性動脈瘤vs炎症性動脈瘤)
内臓動脈の口径不整
内臓動脈を中心とした末梢動脈の口径不整を示す疾患について鑑別をいくつか示す。
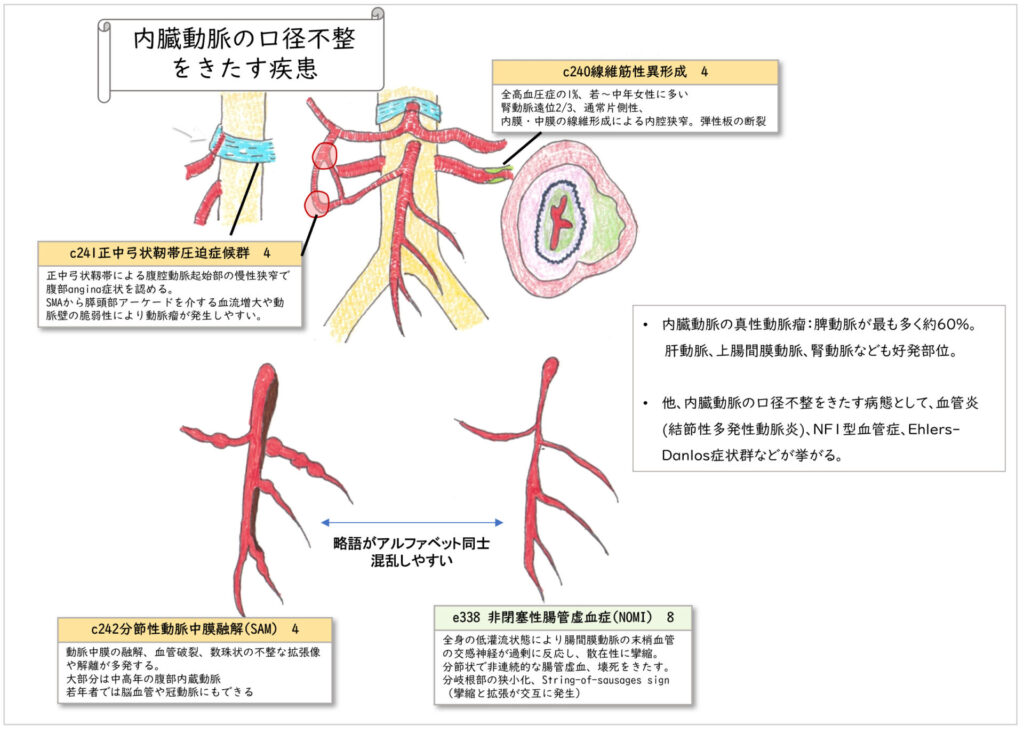









コメント